|
Validation du dépoussiérage des papiers moisis
in Actualités de la conservation ,
n° 26, janvier-décembre 2007
Le développement des micro-organismes sur les ouvrages entraîne une détérioration des matériaux qui les constituent comme la cellulose et le collagène. En conséquence, lors d’une infestation, il est impératif de réagir le plus vite possible en préconisant un traitement des collections mais aussi en agissant sur les causes ayant favorisé le développement de ces micro-organismes. Selon les pays, les techniques recommandées sont différentes, par exemple en France l’usage de l’oxyde d’éthylène est autorisé alors qu’il est interdit dans certains pays qui privilégient des techniques alternatives tel le dépoussiérage des surfaces moisies.
Le présent article fera état d’une étude réalisée sur un support organique : le papier est contaminé puis dépoussiéré après une période de séchage plus ou moins longue, 3 jours à 6 mois. Afin de suivre l’évolution de la contamination, les coupons dépoussiérés sont mis en culture ce qui permet de juger de l’efficacité du dépoussiérage. Ce procédé de décontamination manuel est comparé à un traitement chimique à l’oxyde d’éthylène suivi d’un dépoussiérage.
Protocole expérimental
Sélection des matériaux
Pour cette étude, il a été choisi de travailler sur le support papier. Afin de vérifier si l’ancienneté du matériel a une incidence sur le dépoussiérage, il a été décidé d’effectuer cette étude sur des matériaux neufs et anciens. Ainsi ont été utilisés un papier neuf (le papier Whatman) et un papier en fibres de coton prélevé sur un ouvrage de 1950.
Tous les tests ont été réalisés en parallèle avec deux espèces de moisissures différentes qui sont Penicillium chrysogenum et Aspergillus niger. Ces 2 espèces ont été choisies pour leur fréquence dans la contamination des livres.
Méthodologie
Préparation des coupons
Des lots de coupons d’une dimension de 3 cm x 3 cm ont été préparés dans chaque matériel. Afin de travailler sur des échantillons stériles tous les coupons ont été désinfectés à l’oxyde d’éthylène, technique qui est la moins délétère pour les matériaux. Cette désinfection a été réalisée dans un autoclave, en contact pendant 7h30 avec l’oxyde d’éthylène à une concentration de 650 mg/l.
Contamination des surfaces
Tous ces coupons ont été contaminés soit avec une solution de spores de Penicilliulm chrysogenum à 100 spores/ml, soit avec la solution de spores d’Aspergillus niger à 100 spores/ml. Afin de favoriser la germination des spores, les disques ont été disposés dans des boîtes de Petri contenant du MEA (Malt Extract Agar) et mis à incuber pendant 4 jours dans une étuve régulée à 25°C. Dans ces conditions, les moisissures se sont développées ; l’appareil végétatif, qui permet leur croissance et leur développement, est visible sur les supports. Passé ce délai, chaque échantillon a été retiré de la boîte de Petri puis remis dans une boîte de Petri vide, refermée uniquement par son couvercle et disposée dans une salle à 20°C et 50 % HR, afin de procéder au séchage naturel.
Dépoussiérage
Les coupons moisis ont ensuite été dépoussiérés après une période de séchage
différente, 3 jours,
1 mois, 2, 3 et 6 mois. Ce dépoussiérage a été effectué à l’aide d’un aspirateur
à filtre absolu de norme HEPA (Hight efficiency particulate air Filter) de marque
Nilfisk et la technique de dépoussiérage réalisée selon les recommandations des
restaurateurs. L’efficacité du dépoussiérage est déterminée en comparant visuellement
la contamination initiale à la deuxième remise en culture des échantillons suite
au traitement. L’ampleur de cette contamination est évaluée grâce à une échelle
de mesure établie :
- pas de germination : 0
- nombre d’Unité Formant Colonie (UFC) compris entre 1 et 10 : 1
- nombre d’UFC compris entre 11 et 20 : 2
- surface entièrement couverte de moisissures : 3
Afin de pouvoir comparer ce procédé avec un traitement de désinfection, pour chaque lot un échantillon est désinfecté à l’oxyde d’éthylène puis dépoussiéré ( cf. tableau 1).
Tableau 1 : récapitulatif de la méthodologie |
||
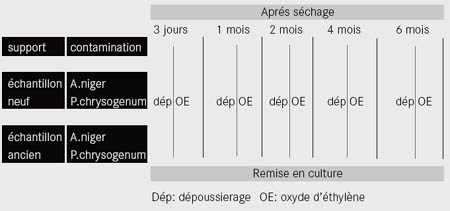 |
Par ailleurs, pour chaque lot dépoussiéré des témoins sont utilisés afin de réaliser deux types de photos : des photos numériques et des photos au microscope électronique à balayage (MEB) ce qui permet de voir l'état des surfaces après traitement.
Résultats
Résultat du dépoussiérage D’un point de vue pratique le dépoussiérage n’est pas aisé sur des moisissures en développement car le corps de la moisissure est encore présent sur les supports. Ce mycélium constitué d’hyphe ramifié contient entre ses parois des substances liquides qui sont libérées par écrasement lors du dépoussiérage. Elles se propagent alors, collant les spores sur les surfaces ce qui freine fortement leur aspiration. Ce problème diminue avec la durée de séchage, ainsi après 1 mois minimum, le dépoussiérage commence à être plus facile et au-delà de 4 mois il est beaucoup plus aisé, car le mycélium a disparu suite à l’assèchement des spores.
D’un point de vue esthétique, le dépoussiérage sur des moisissures fraîches tache tous les supports (cliché 2), notamment le papier et le textile, en raison de l’écrasement des hyphes sur le support libérant ainsi un liquide coloré. Au contraire, plus le séchage est long et moins les surfaces sont tachées. Par ailleurs, le dépoussiérage des supports moisis par Aspergillus niger tache beaucoup plus que celui de Penicillium chrysogenum, cette différence est due aux pigments que produit cette espèce de moisissure.
Résultat des prises de vues Ainsi, dans la première série de photos numériques, les moisissures en développement apparaissent filamenteuses, duveteuses, de plus elles sont humides au toucher (photo 1). Quant aux moisissures sèches, plus la durée de leur séchage est longue et plus elles apparaissent granuleuses. L’utilisation du microscope électronique à balayage nous permet de constater que les surfaces des échantillons témoins (photos 3-4) sont propres. En revanche, sur les surfaces dépoussiérées neuves ou anciennes, une couche de spores se crée à la surface des papiers (clichés 5-8). Cette couche est composée de têtes conidiennes écrasées (cliché 6) et de spores. De plus, la composition de cette couche varie selon le délai de séchage. En effet, pour un séchage court elle est composée essentiellement de têtes conidiennes écrasées et pour des séchages plus longs, au- delà de 1 mois, elle est composée de spores agglomérées (cliché 8). |
||||
 Photo 1 : Photographie numérique de surfaces moisies A : Papier ancien témoin ; B : papier ancien contaminé J+7 ; C : papier ancien dépoussiéré J+1 mois ; D : papier Whatman dépoussiéré J+2 mois et remis en culture : E Papier Whatman dépoussiéré J+4 mois et remis en culture |
 Photo 2 : Papier whatman contaminé et dépoussiéré |
|||
 Photo 3 : Surface du papier Whatman témoin |
 Photo 4 : Surface du papier ancien témoin |
|||
 Photo 5 : Support papier contaminé par Aspergillus niger |
 Photo 6 : Surface dépoussiérée après 3 jours de séchage |
|||
 Photo 7
: Surface dépoussiérée après 1 mois de séchage |
 Photo 8 : Surface dépoussiérée après 4 mois de séchage |
|||
Résultats microbiologiques
Nous avons constaté une très nette augmentation de la contamination et un envahissement très rapide des surfaces quelle que soit la souche et quelles que soient la durée de séchage et la nature du support, neuf ou ancien (tableau 2). Par ailleurs, nous n’avons pas noté de différences sensibles entre l’efficacité du dépoussiérage des surfaces neuves et anciennes ni de différence entre les souches.
Tableau 2 : résultats microbiologiques de la mise en culture des échantillons dépoussiérés |
||
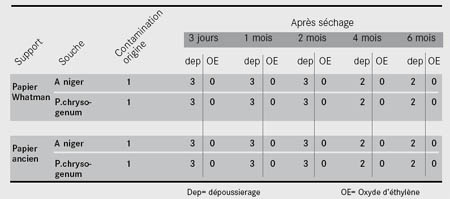 |
Les résultats de la remise en culture des échantillons après un traitement à l’oxyde d’éthylène sont négatifs, aucune moisissure ne s’est développée malgré la présence de spores à la surface ce qui valide le traitement de désinfection à l’oxyde d’éthylène. Ainsi, un simple dépoussiérage des surfaces moisies ne permet pas de les décontaminer, au contraire il contribue à un accroissement de la contamination par l’étalement des spores viables à la surface des échantillons.
Interprétations - Discussions
Les résultats obtenus nous permettent d’affirmer que le dépoussiérage augmente la contamination quand il est réalisé notamment sur des moisissures en développement. Ceci s’explique par l’humidité contenue dans le mycélium des moisissures qui permet aux spores d’adhérer aux surfaces et de ne pas être aspirées. De plus, les têtes conidiennes très fragiles dispersent très facilement les spores au moindre choc, frottement ou courant d’air. Il se crée ainsi une couche de spores viables sur toute la surface des supports comme le montrent les photographies au MEB. Ces spores viables sont en dormance et sont capables de germer si les conditions environnementales, l’humidité relative notamment, le permettent. La viabilité de ces spores reste identique quelle que soit la durée de séchage si aucun traitement de désinfection n’est réalisé. Ainsi, le dépoussiérage des supports moisis ne peut être réalisé sans une expertise préalable permettant de vérifier, par des analyses microbiologiques, la viabilité des spores de moisissures et de préconiser le traitement curatif adéquat.
Tony Basset,
BnF, laboratoire
Laure Simeone, BnF, laboratoire